Las cuatro propiedades coligativas de la materia son la depresión del punto de congelación la elevación del punto de ebullición la disminución de la presión de vapor y la presión osmótica. Por ejemplo alcl 3 y k 3 po 4 exhibiría esencialmente las mismas propiedades coligativas ya que cada compuesto se disuelve para producir cuatro iones por unidad de fórmula. Las propiedades coligativas incluyen disminución de la presión de vapor elevación de la temperatura de ebullición descenso de la temperatura de congelación y de la presión osmótica.

Las propiedades de una solución que depende de la concentración de las partículas de soluto y no de su identidad se conocen como propiedades coligativas. Física y química 1 bachillerato y universidad. Explicaremos la fórmula de la presión osmótica y realizaremos unos problemas hasta ser unas máquinas.
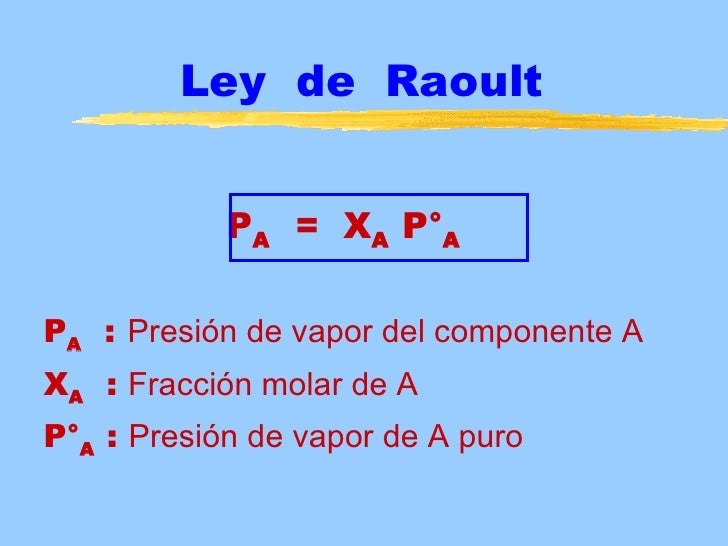
Presión osmótica fórmula y ejercicios resueltos propiedades coligativas de las disoluciones. Este principio ha sido demostrado mediante experimentos en. La disminución de la presión del disolvente es proporcional a la fracción molar de soluto disuelto.

Esta propiedad esta reflejada en la ley de raoult un científico francés francois raoult quien enunció el siguiente principio. Propiedades coligativas la presión de vapor. Disminución de la presión de vapor comparte esto.

Leave a comment full size 448 393 pixels propiedades coligativas. Fórmulas presión de vapor. Disminución de la presión de vapor fórmulas presión de vapor.

Home guía de estudios propiedades coligativas. M molalidad del soluto mol kg 1. Ke constante ebulloscópica k kg mol 1.
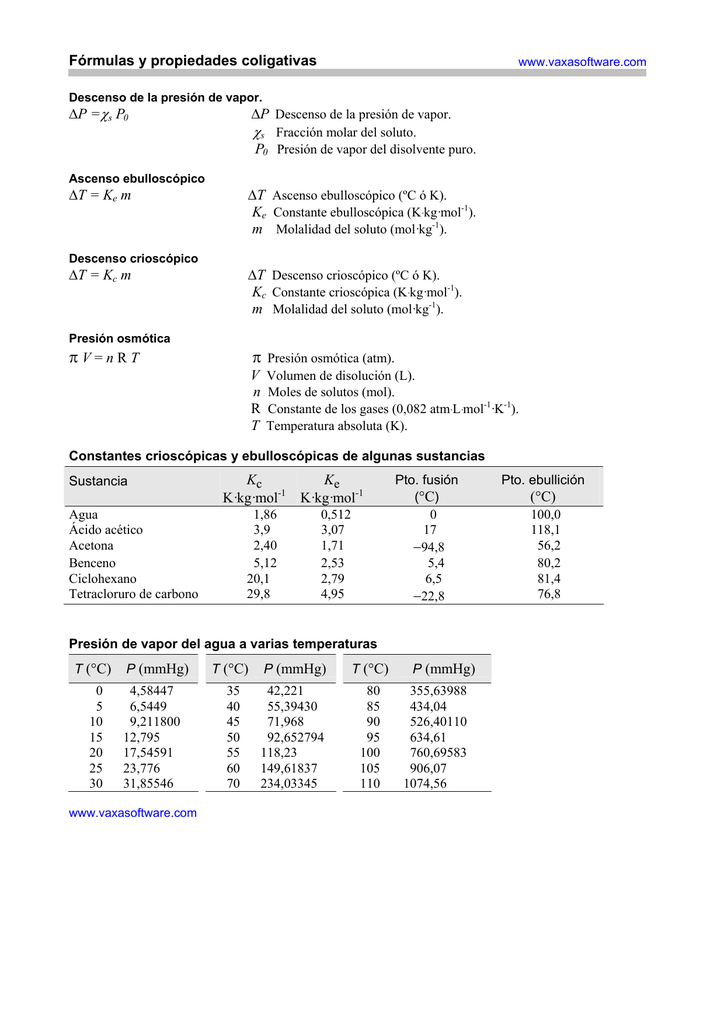
Ascenso ebulloscópico t ke m t ascenso ebulloscópico ºc ó k.
Propiedades coligativas presion de vapor formula. δp disminución o variación de la presión de vapor p ste presión de vapor del solvente puro. P soluc presión de vapor de la solución. Xsto fracción molar del soluto. Xste fracción molar del solvente.
La presión de vapor se expresa en las unidades. Mmhg milímetros de mercurio y en atm atmósfera. En caso de que se necesite realizar alguna conversión de. Las propiedades coligativas se estudian principalmente para las soluciones diluidas por su comportamiento casi ideal y son las siguientes.
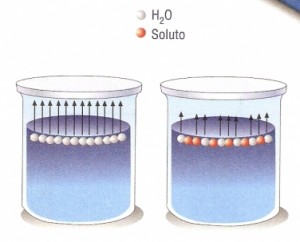
Disminución de la presión de vapor. Se puede decir que la presión de vapor de un líquido es la presión en equilibrio de las moléculas de vapor con las que se encuentra en. Estas son las llamadas propiedades coligativas. Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos.
Son función sólo del número de partículas y son resultado del mismo fenómeno. El efecto de las partículas de soluto sobre la presión de vapor del disolvente ver figura. La presión de vapor de una so lución de un sólido en un líquido volátil es igual al producto de la presión de vapor del solvente puro por la fracción molar del solvente. Ahora que conocemos el descenso de la presión del vapor del solvente procederemos a estudiar otra propiedad coligativa.
El ascenso del punto de ebullición de la. P s p0 p descenso de la presión de vapor. S fracción molar del soluto. P0 presión de vapor del disolvente puro.

P0 presión de vapor del disolvente puro. S fracción molar del soluto. P s p0 p descenso de la presión de vapor.

El ascenso del punto de ebullición de la. Ahora que conocemos el descenso de la presión del vapor del solvente procederemos a estudiar otra propiedad coligativa. La presión de vapor de una so lución de un sólido en un líquido volátil es igual al producto de la presión de vapor del solvente puro por la fracción molar del solvente.

El efecto de las partículas de soluto sobre la presión de vapor del disolvente ver figura. Son función sólo del número de partículas y son resultado del mismo fenómeno. Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos.

Estas son las llamadas propiedades coligativas. Se puede decir que la presión de vapor de un líquido es la presión en equilibrio de las moléculas de vapor con las que se encuentra en. Disminución de la presión de vapor.

Las propiedades coligativas se estudian principalmente para las soluciones diluidas por su comportamiento casi ideal y son las siguientes. En caso de que se necesite realizar alguna conversión de. Mmhg milímetros de mercurio y en atm atmósfera.

La presión de vapor se expresa en las unidades. Xste fracción molar del solvente. Xsto fracción molar del soluto.

P soluc presión de vapor de la solución. δp disminución o variación de la presión de vapor p ste presión de vapor del solvente puro.